TRABAJO DE QUIMICA
La tabla periodica de los elementos quimicos
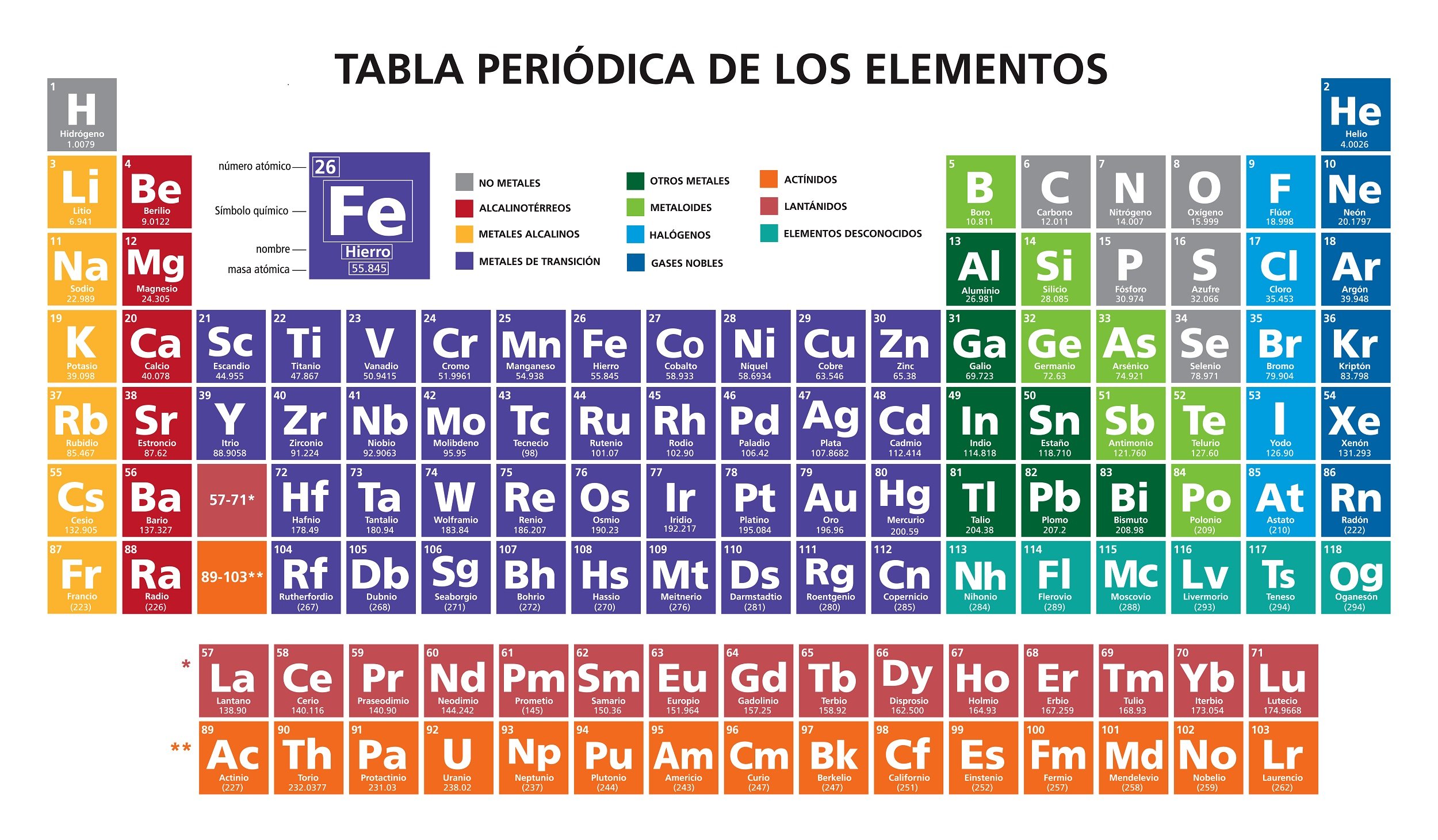
La tabla periodica de los elementos es una dispocicion de los elementos quimicos en forma de tabla,ordenados por su numero atomico por su configuracion de electrones y propiedades quimicas.este ordenamiento muestra tendencias periodicas como elementos con comportamieto imilar e la misma columna.En palabras de Theodor Benfey la tabla y la ley periodica son elcorazon de la quimica
Historia De La Tabla Periodica
La historia de la tabla periódica está muy relacionada con varios aspectos del desarrollo de la química y física:
- El descubrimiento de los elementos de la tabla periódica.
- El estudio de las propiedades comunes y la clasificación de los elementos.
- La noción de masa atómica (inicialmente denominada «peso atómico») y, posteriormente, ya en el siglo XX d. C., número másico.
- Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos y la aparición de nuevos elementos.
Sistema Peridicos
A medida que aumentaba el número de sustancias conocidas se hacía más necesario organizar y estructurar el conocimiento. El primer esquema de clasificación lo adoptó J. Berzelius en 1813 dividiendo los elementos en dos grandes grupos: metales y no metales.
El químico inglés J.A Newlands enunció en 1865 una ley de las octavas similar a la escala musical. Consiguió ordenar algunas filas, pero no se conocían los gases nobles y no se encontraron sitios para elementos recién descubiertos.
En 1869, el químico alemán L. Meyer (1830- 1895) puso en evidencia una cierta periodicidad en el volumen atómico. Casi simultáneamente, el químico ruso Mendeleiev (1834-1907) presentó una tabla periódica en la que clasificaba los elementos según sus masas atómicas crecientes.
Al hacerlo, aparecían ordenados en la vertical elementos de propiedades químicas semejantes.
Dejó huecos cuando no aparecían elementos que encajaran y predijo la existencia de elementos no conocidos.
En 1911, Mosely propuso ordenar los elementos por su número atómico Z creciente. Siguiendo este criterio Werner y Paneth propusieron en 1952 el sistema periódico actual.
Metales y no Metales
Los elementos químicos se clasifican en metales y no metales. Los metales son las sustancias que conducen electricidad, pueden formar láminas o alambres y tienen brillo. Los no metales son todas aquellas sustancias que no conducen electricidad, son frágiles a la manipulación o son gases.
La principal característica que diferencia los metales de los no metales es la capacidad de conducir la electricidad.
Existen elementos que parecen metales, pero reaccionan como no metales. Estos elementos se conocen como metaloides y son el boro, el silicio, el germanio, el arsénico, el antimonio, el telurio y el polonio.
Propiedades Periodicas
Cuando nos desplazamos verticalmente por los grupos u horizontalmente por los periodos de la tabla periódica se puede notar que hay un cambio relativamente uniforme en las propiedades que exhiben los elementos, razón por la cual se conoce a éstas como propiedades periódicas.
La ley periódica nos dice que si ordenamos los elementos según su número atómico creciente encontramos en forma periódica elementos que tienen propiedades químicas y físicas semejantes. Los elementos de un grupo tienen propiedades similares, mientras que las propiedades de los elementos de un periodo cambian de manera progresiva al recorrer la tabla (Whitten, 2008, p.120).
Las tendencias observadas en las propiedades periódicas como el radio atómico, energía de ionización y afinidad electrónica, entre otras, guardan relación con las configuraciones electrónicas y carga nuclear efectiva de los elementos, por lo que permiten explicar y predecir el comportamiento químico y las propiedades físicas de aquellos que se encuentran en un mismo grupo o periodo.
Comentarios
Publicar un comentario